谷子是具有耐旱、耐瘠薄特性的杂粮作物,其产业化发展长期受制于田间杂草危害与机械化应用水平低下的双重瓶颈。草铵膦作为全球广泛使用的非选择性除草剂,其作用机制是通过不可逆抑制谷氨酰胺合成酶(GS)的活性,引起植物体内氨积累,造成氨毒害并破坏光合作用,最终导致植株死亡。近年来,基于CRISPR/Cas9系统开发的碱基编辑技术,能够实现对内源除草剂靶标基因进行精准、高效的位点编辑,为定向创制抗草铵膦谷子种质提供了可靠的技术路径。该抗性性状的成功导入,将有效克服谷田草害管理的机械化障碍,为实现谷子生产全程机械化、推动其全面融入现代谷物产业体系奠定关键基础。

12月24日,我校农学院谷子产业化技术创新团队在Plant Biotechnology Journal上发表题为“CRISPR/Cas9-Mediated Base Editing ofSiGS1Confers Glufosinate Resistance in Foxtail Millet (Setaria italica)”的研究论文。在本研究中,通过腺嘌呤碱基编辑器(ABE8e)对SiGS1基因进行精确编辑,成功产生了S59G-T60A(SGTA)突变,同时编辑植株对草铵膦表现出稳定的抗性。
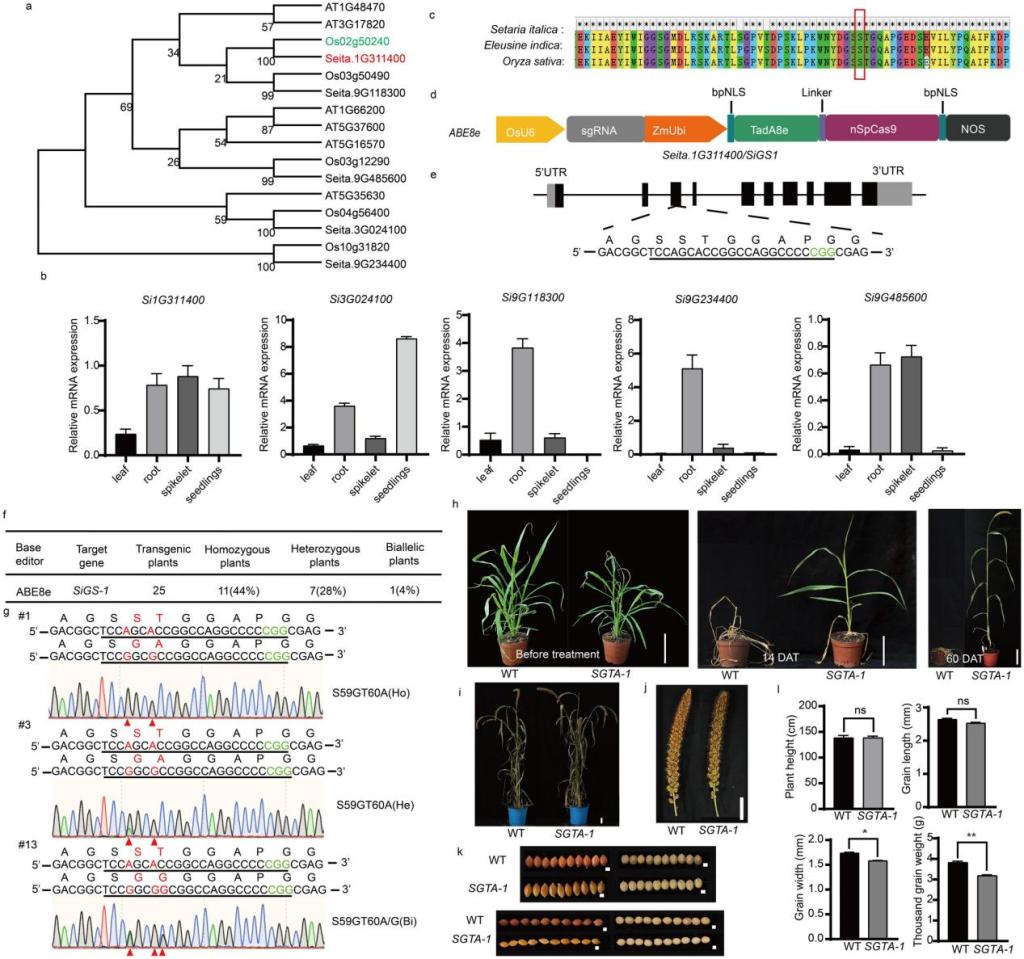
通过对 SiGS1 的碱基编辑培育出抗草铵膦的谷子品种
本研究系统鉴定了谷子中的SiGS基因家族,共鉴定出五个SiGS基因成员,其中SiGS1与水稻OsGS1具有最高的序列同源性,提示其在功能上可能具有保守性(图1a和 图S1)。qRT-PCR分析显示,SiGS1在各组织中的表达水平较为均衡(图1b)。亚细胞定位实验进一步证实该蛋白定位于细胞质,与其作为谷氨酰胺合成酶的功能定位一致(图S2)。为探索其在草铵膦抗性中的潜在应用价值,研究团队构建了SiGS1过表达系与敲除系,然而植株对草铵膦的耐受性提升有限,未能实现显著抗性改良(图S3-S4)。基于自然界中已报道的抗性突变(如牛筋草中S59G突变)可有效降低草铵膦与靶标酶结合能力的机制,本研究采用精准基因编辑策略,旨在通过编辑SiGS1基因本身以实现功能优化。利用高效腺嘌呤碱基编辑器ABE8e,成功实现了对SiGS1基因的定点编辑,获得携带S59G-T60A(简称SGTA)突变的纯合植株(图1c-g)。经草铵膦处理后,编辑植株表现出稳定且显著的抗性表型(图1h)。生理分析结果表明,相较于野生型,抗性植株中谷氨酰胺合成酶(GS)活性显著提高,多种抗氧化酶(SOD、POD、CAT)活性亦明显增强,有效缓解了草铵膦诱导的氧化损伤;同时,光合色素含量得以较好维持,叶片生理状态更为稳健(图S5)。尤为关键的是,SiGS1-SGTA纯合植株在生长发育过程中未出现明显抑制,主要农艺性状与野生型相比基本一致,仅千粒重略有下降,表明该精准编辑策略在赋予强抗性的同时,最大程度保留了植株正常的生长性能和产量潜力(图i-l)。
本研究成功建立了适用于谷子的高效碱基编辑技术体系,并通过精准编辑SiGS1基因,创制出兼具强草铵膦抗性与优良农艺性状的谷子新种质,为谷子及其他作物的抗除草剂育种提供了切实可行的技术方案和宝贵的遗传资源。
农学院2023级硕士研究生陈嘉怡为文章第一作者,农学院谷子产业化技术创新团队王家刚教授、王宏智老师和原向阳教授(团队首席)为文章的共同通讯作者,董淑琦教授、李晓瑞副教授、褚晓茜副教授、杨光辉老师和高路路老师也参与了本研究工作。
论文链接: https://doi.org/10.1111/pbi.70440